每日經濟新聞 2022-05-27 22:50:33
◎離終點越來越近,國產新冠藥物研發的參與者們都卯足了勁。誰將第一個撞線?跑在隊伍前列的,是君實生物、真實生物和開拓藥業三家。
◎香港大學生物醫學學院教授、病毒學專家金冬雁也在5月18日接受《每日經濟新聞》記者電話采訪時表示,“不管什么藥,不管黑貓白貓,只有上了臨床看結果才知道是不是好貓”。
每經記者|陳星 林姿辰 北京報道 每經編輯|陳俊杰
對于新冠疫情而言,新冠藥物是補齊疫情防控閉環的最后一角拼圖。隨著君實生物、真實生物、開拓藥業密集公布新冠藥物研發進展,“國產新冠藥物進入上市前的最后一夜”。
每一次臨床試驗進展公布、監管部門發布最新動態,二級市場起伏的曲線和投資者熱切的詢問都在強調著新冠口服藥的重要意義。也正因新冠藥物的重要意義,其每一道臨床試驗程序的嚴謹和每一個實驗數據的含金量都經歷著千萬雙眼睛的檢驗。越到關鍵時刻,裁判和觀眾的眼睛都盯著有望率先撞線的運動員。
5月18日,香港大學生物醫學學院教授、病毒學專家金冬雁在接受《每日經濟新聞》記者電話采訪時表示,“不管什么藥,不管黑貓白貓,只有上了臨床看結果才知道是不是好貓”。
金冬雁還說,“我們需要發展抗病毒藥,但把這個東西說成是萬能的、說成是靈丹妙藥,那是不對的”。
新冠口服藥進入“撞線”時刻。
一周內,國內新冠口服藥密集公布研究進展。最近,5月23日,君實生物公布VV116在一項對比PAXLOVID的III期臨床試驗中達到主要終點。
離終點越來越近,國產新冠藥物研發的參與者們都卯足了勁。
誰將第一個撞線?跑在隊伍前列的,是君實生物、真實生物和開拓藥業三家。
根據君實生物最新披露的信息,前述對比PAXLOVID的III期臨床試驗中達到主要終點意味著該臨床試驗已經成功,公司將與監管部門溝通遞交上市申請。真實生物非上市公司,其未對外公開披露過阿茲夫定的研究進展。但根據國家藥監局藥品審評中心公布的溝通交流公示信息,真實生物分別于今年3、4月申請Ⅱ類會議和Ⅲ類會議,狀態均為“已反饋”。這一變化也被市場認為阿茲夫定上市申報在進行時。開拓藥業的普克魯胺在今年4月公布了治療輕中癥的III期全球多中心臨床試驗最終關鍵結果,市場預計將在今年二季度提交上市申請。
在這三家身后,還有先聲藥業、歌禮制藥、云頂新耀、廣生堂等多個企業參與新冠口服藥競賽。
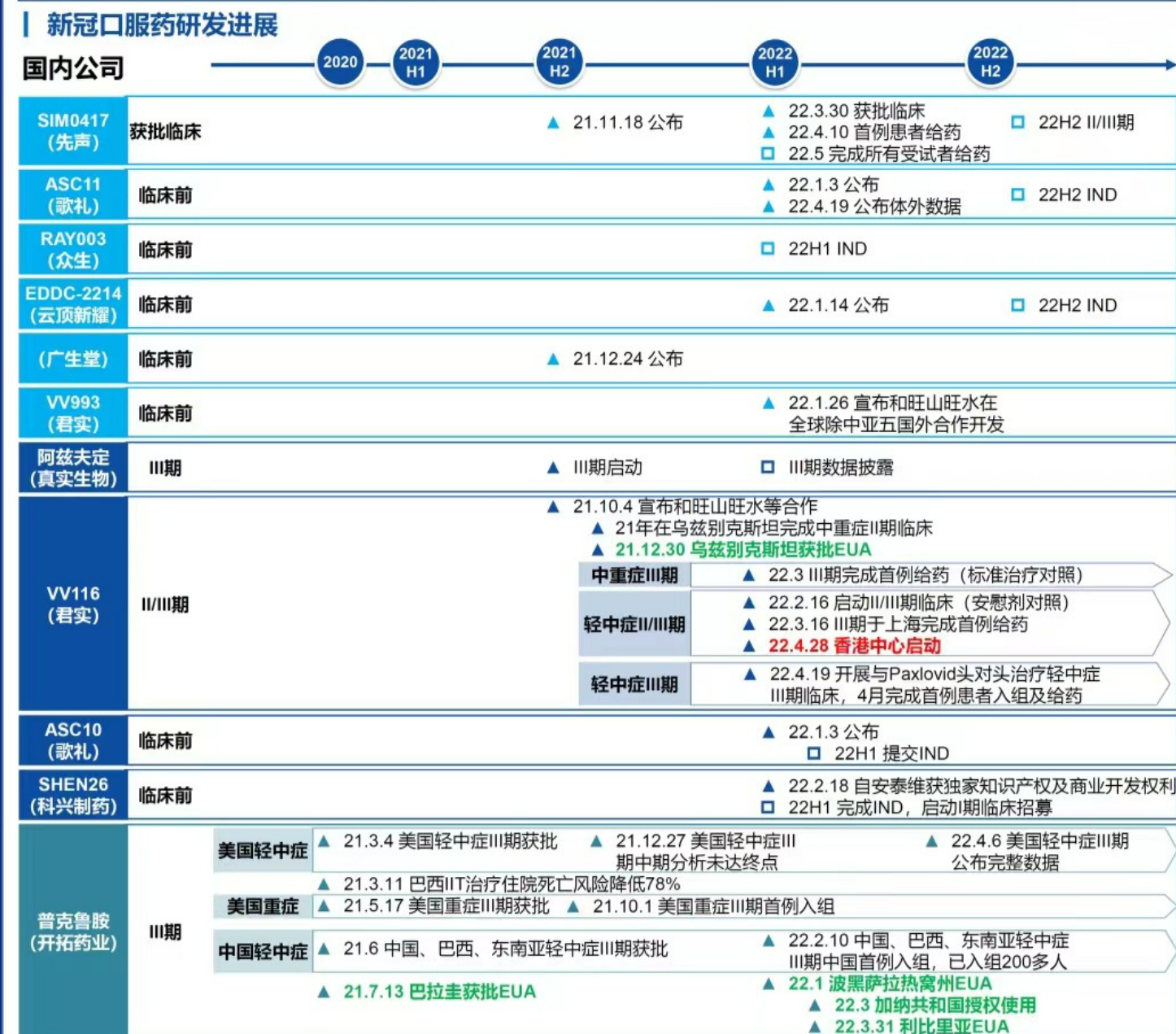
國產新冠藥物研發進展圖據華創證券
雖然答案還未揭開,但新冠口服藥概念已經讓二級市場提前熱鬧了起來。
在各種股吧和投資平臺,投資者們猶如臨床科學家一般分析著3CL、RdRp等技術路徑的區別;比較著輝瑞、默沙東、君實生物等企業之間的臨床試驗設計差異;逐字逐句拆解著藥審中心發布的新冠肺炎藥物臨床指導原則。
投資者們試圖從每一則上市公司公告、國家藥監局的每一次信息公示、每一個試驗數據中分析新藥上市的時間表和可能性,希望自己和公司能共同成為幸運寵兒。
以新冠藥物阿茲夫定為例,其先后與新華制藥、華潤雙鶴及奧翔藥業簽訂生產經銷合同。近一月內,新華制藥拉出一條陡峭的上漲曲線,從4月25日收盤價9.38元/股攀升至5月25日的31.90元/股;華潤雙鶴則是從合作事項公布前的一個多月就遭遇資金熱炒,從4月1日至今,股價已然翻倍;奧翔藥業則在官宣合作前連續三個交易日漲幅累計超過20%。
而在君實生物公布VV116三期臨床試驗結果并稱將遞交上市申請的5月24日,君實生物科創板股票卻跌停了,港股創下逾12%的跌幅。在某投資平臺上,投資者依次羅列出該試驗為單盲試驗、主要終點設計與已獲批藥物輝瑞PAXLOVID不一致及入組人數偏少等原因,認真分析著君實生物該臨床試驗設計的“不足”。
新冠口服藥的熱度背后,是口服藥的上市日程漸近,也是市場對于補齊這新冠防控最后一環的盼望與希冀。
新冠口服藥的火,從輝瑞PAXLOVID于今年2月獲得CDE批準上市開始燃起。彼時距離PAXLOVID在美獲批,不過短短兩月時間。輝瑞口服藥在國內獲批速度之快,讓靈敏的資本市場反應過來——新冠口服藥或許是今年在新冠疫苗之外的又一個市場主旋律。
而參與其中的制藥企業明白,只有加速再加速,才能成為疫情防控決心和希望的真實載體。
以老藥新用的兩款藥物阿茲夫定和普克魯胺為例。阿茲夫定原是一款雙靶點抗HIV藥物,其關于新冠感染的全球多中心臨床于2020年2月份啟動,此前基本已經做好安全性和藥物吸收等評價,這意味著阿茲夫定新開一個適應癥能夠省去很多臨床前的步驟。
但其間,除真實生物微信公眾號發文稱阿茲夫定治療新冠肺炎的三期臨床試驗正在中國、巴西和俄羅斯全力推進外,鮮有阿茲夫定臨床進展傳出。
4月27日,中國醫學科學院新聞中心微信公眾號發布一篇由中國醫學科學院學部委員、中國工程院院士蔣建東為作者的文章,文章稱在體外實驗中阿茲夫定的藥效遠不如另一種用于抗新冠肺炎的新藥瑞德西韋,但是在新冠肺炎患者體內,阿茲夫定比瑞德西韋報道的藥效要好。服用阿茲夫定后,患者一般3~5天核酸轉陰,用藥大約需要持續6~7天,對輕癥、重癥患者療效相當,且不受其他治療影響。
隨著臨床療效信息的傳開,阿茲夫定上市將近的聲音越來越甚。
而普克魯胺是由開拓藥業研發的雄激素受體(AR)拮抗劑,是一款前列腺癌和乳腺癌治療藥物。針對新冠輕癥患者和重癥住院患者,開拓藥業直接發起了普克魯胺的國際多中心注冊臨床。其中,一項美國患者為主的輕中癥臨床(NCT04870606)進展在前,去年12月,開拓藥業曾公告這項臨床試驗中期數據沒有達到顯著性,引發公司股價大跌。然后今年4月,試驗結果卻迎來“反轉”。
4月6日,開拓藥業微信公眾號發文稱,關鍵數據結果顯示,普克魯胺可有效降低新冠患者的住院/死亡率,特別是對于服藥超過7天的全部患者,相應保護率達100%。
文中,開拓藥業創始人、董事長童友之表示,公司將積極推進向中國、美國及其他國家和地區的國家藥物監督機構申請緊急用藥EUA許可。
開拓藥業曾表示,中期與終期數據結果有異,是由于采取了“全人群”患者入組標準,未限定在未接種新冠疫苗人群或高風險人群,因此中期分析沒有達到統計學顯著性。
與阿茲夫定、普克魯胺均是“老藥”不同,君實生物與旺山旺水合作的VV116是一種 RdRp 抑制劑,結構與瑞德西韋類似,但在瑞德西韋的基礎上改善了口服生物利用度。今年3月,VV116公布了3項I期臨床結果,緊接著同月,一項國際多中心、雙盲、隨機、安慰劑對照的 II/III 期臨床研究就完成首例入組及給藥。而前述對照Paxlovid的III期試驗則在4月完成首例入組及給藥,5月24日,君實生物公布這項試驗達到主要終點。速度之快,令人矚目。
不難看出,在2月PAXLOVID獲批后,國產新冠藥的研發進度明顯加快,研究進展在今年2月后密集出爐,在4、5月達到頂峰。
5月25日,一位醫藥行業投資人在接受《每日經濟新聞》記者微信采訪時表示,奧密克戎的大規模傳播讓人們意識到疫苗屏障并不是牢不可破,藥物就像那個漏水的短板,雖然補上之后不能確保水不外溢,但社會和市場都需要這個信心。
“但在輝瑞PAXLOVID獲批之前,業內對新冠藥物能不能獲批、何時獲批沒有預期。PAXLOVID在兩個月的時間里就在國內獲批,說明了監管的態度。而醫保‘保基本’的需要還得國產藥物來滿足。這個背景下,誰的臨床試驗在合規、科學的前提下跑得越快,誰就能拿到首張通行證。”這位投資人說。
在市場望眼欲穿、企業加速沖刺、監管準備審評的背景下,不少業界人士呼吁,不能為了盡早讓國產新冠藥物獲批而放松臨床或審批要求。
然而,不能調整臨床試驗原則,與現行疫情形勢之間產生了一些矛盾。
以臨床設計試驗終點為例,今年2月發布的《新型冠狀病毒肺炎抗病毒新藥臨床試驗技術指導原則(試行)》規定,在輕型和/或普通型新型冠狀病毒肺炎治療研究中,首先推薦在適當時間點發展為重型/危重型的發生率或全因死亡率作為主要療效終點。
而在輕型和/或普通型新型冠狀病毒感染治療研究中,主要療效終點也可選擇在適當的時間內評估至持續臨床恢復的時間。但應事先明確臨床恢復的定義,一般參考當前臨床治療指南,可考慮包括臨床癥狀、影像學、病原學的聯合評價。
這也就是說,按照現行的新冠藥物臨床試驗指導原則,重癥和死亡率仍是首要推薦的主要終點。
但另一位從事藥物研發的科研人員坦言,國家藥監局對國內新冠口服藥III期臨床試驗的現行審批標準,依舊是以癥狀改善為“臨床主要終點”,尤其是“降低低重/危重患者的死亡率”。但當現在奧密克戎變異株使得感染人群大多是無癥狀或者輕癥時,重癥患者很少,這樣的情況下臨床試驗就很難進行。但是如果不按照這個有效性終點來設計,很難獲批做III期臨床試驗。
以君實和輝瑞的頭對頭試驗為例,其主要終點為“持續臨床恢復時間”,而原本的主要終點之一“重癥率轉化和全因死亡”變成了次要終點。
針對奧密克戎導致病人整體癥狀輕的情況,業內曾傳出建議將“降低病毒載量”作為主要終點指標。所謂病毒載量,簡單理解就是指病毒在人體內的含量。患者轉陰時間等觀察指標,都與病毒載量相關。但反對者認為,病毒載量不屬于三期臨床試驗的主要指標,三期臨床試驗指標的選擇應當還是取決于對疾病嚴重情況的觀察。臨床難做不應該是藥監局降低審評標準的理由。
除試驗主要終點引起爭議外,前述君實生物VV116與PAXLOVID的頭對頭試驗中,僅822例的入組量和單盲試驗方式也引起討論。5月27日,病毒學專家常榮山通過微信對《每日經濟新聞》記者表示,單盲試驗會影響臨床試驗醫生的主觀意識,繼而影響試驗的權威性。常榮山認為,當君實生物發起上市申請時,可能會被要求補充更大樣本量的臨床。
不過,記者也注意到,根據中國臨床試驗注冊中心網站上公布的研究方案以及君實生物在君實醫學平臺上發布的文章,此次VV116研究采用的單盲設計是在研究結束最終數據庫鎖定前,研究者(包括研究終點評估者)和申辦方都不會知道具體的治療藥物分配情況,也就是對研究者設盲,而患者不盲。
常榮山認為,不管是針對還未進入臨床階段的新冠藥物,還是已經上了臨床的項目,都不能用非科學的前提去調整設計或放松指標。“輝瑞PAXLOVID降低住院率或死亡率的有效率為89%,獲批的藥物至少應該優于或者不劣于這一數據。毒株的變化不應該成為調整臨床要求的理由,藥監局不應該也不會降低審評標準”。
香港大學生物醫學學院教授、病毒學專家金冬雁也在5月18日接受《每日經濟新聞》記者電話采訪時表示,“不管什么藥,不管黑貓白貓,只有上了臨床看結果才知道是不是好貓”。
金冬雁還表示,當下的新冠疫情已經進入另一個階段,大部分感染是接種疫苗之后出現的突破性感染,我們需要的新冠藥物是要么可以防止重癥的藥物、要么是可以預防感染的藥物。如果只是單純的病毒載量變低,而對預防重癥或預防感染都沒有作用,可以說在臨床上是沒有意義的。
國產新冠藥物未出生而先爆火,與資本世界勾勒出的美好前景有關。
根據輝瑞披露的今年一季度收益,其新冠疫苗和新冠口服藥銷售強勁,收入分別為132億美元和15億美元,拉動當季度收入同比增長77%。輝瑞預計,公司今年總銷售額將達到980億美元至1020億美元,并給出新冠疫苗收入320億美元,Paxlovid收入220億美元的銷售指導。默沙東研發的新冠口服藥Molnupiravir則在今年一季度實現收入32億美元,超過全年預期銷售額的一半。
而在去年底,西南證券曾對全球口服新冠藥物市場規模進行估算,2021年全球新增患者約1.4億人,假設口服藥物每療程單價分別為500/300/100美元,對應市場空間分別為700億/420億/140億美元。
關鍵是,國產新冠藥物帶來的想象力不僅賦予了生產企業,還覆蓋了產業鏈上下游。
中信證券研報認為,國產小分子新冠藥物產能潛在需求大,預計為國內CDMO行業帶來數十億元增量訂單。東吳證券朱國廣團隊則認為,隨著口服新冠治療藥物VV116及阿茲夫定逐步完成三期臨床,隨著國內獲批,對中間體、原料藥需求量較大,如果按照每人12片、每片300mg,預估80億-100億市場,相關原料藥龍頭公司有望獲益。
不過,如金冬雁所說,新冠藥物始終只是新冠防控中的一環,“如果不打疫苗而選擇感染后吃藥,是不符合成本效益的。藥物是第二道防線,第一道防線是疫苗,藥物的作用永遠也取代不了疫苗”。
金冬雁告訴記者,新冠藥物的最佳使用時間越早越好,一般是初次抗原檢測陽性時服用。例如Paxlovid的國內獲批適應癥為“發病5天以內的輕型和普通型且伴有進展為重癥高風險因素的成人”。
但在以奧密克戎毒株為主導的本輪疫情中,確診新冠的患者大多為輕癥,病程較短,并不是新冠口服藥的適用群體,不加區別地使用藥物不僅不符合成本效益,而且可能導致患者的抗藥性。
此外,雖然目前國內疫苗接種率極高但仍有感染者,這是由于出現了“突破性感染”所致。只要他們不是免疫缺損人群,其體內就能夠自然形成相應抗體,并且抗體效果遠遠優于中和抗體等新冠藥物,“(兩種抗體的效果)是千軍萬馬和幾個士兵的區別”。
金冬雁認為,眼下新冠藥物的主要功能還是降低重癥和死亡率,而不是預防新冠用作防疫“安全網”。
這一說法得到了常榮山的認同。常榮山表示,從目前所有新冠藥物已經完成和進行中的臨床試驗來看,藥物對預防新冠的效果都是不明顯的,這一功能只能通過前期疫苗實現。在奧密克戎毒株流行后重癥死亡率較低、疫情處于地區流行而非全球大流行的背景下,口服藥的市場實際上是比較小的。
前述新冠藥物的研發人員也坦言,疫情發展至今,說明任何一種預防或者治療手段都不是“萬能的”。現階段的疫苗、中和抗體和小分子藥物,仍然是互相互補,需要有不同機制的疫苗和藥物來解決不同人群的預治結合的需求。新冠口服藥物大大提高了可及性和便利性,對于國家疫情防控有戰略意義。
“我們需要發展抗病毒藥,也需要發展抗體藥,但把這個東西說成是萬能的、說成是靈丹妙藥,那是不對的。”金冬雁說。
封面圖片來源:攝圖網-501385869
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
